实验一 天然水中铜的存在形态
一、目的要求
1、判别铜在湖水中几种简单的结合状态。
2、学习用阳极溶出伏安法测定水中金属结合状态的一般实验技术。
3、熟悉掌握XJP—821(B)型新极谱仪的使用方法。
二、概述
天然水中重金属的存在形态,按其物理状态可分为颗粒态和溶解态两类。前者包括吸附、络合于悬浮物粒子上的各种化学态。后者按其在水中的活性又分为稳定态和不稳定态。不稳定态主要包括游离的金属离子,弱结合的有机和无机的络合吸附态金属。处于这一状态的金属有电活性,在电极上能反应。稳定态主要包括强结合的有机和无机络合吸附态金属。它们在电极上无反应。但经紫外光照射后,其中的有机结合态,即稳定态A,会变成不稳定态。不被紫外光分解的部分,即稳定态B,经硝酸—高氯酸消化后也会变成不稳定态。不稳定态有电活性,能被微电极富集,可用溶出伏安法测定。
在适当的底液及外加电压下,不稳定态铜可以还原为金属铜沉积在工作电极上。即不稳定态铜有电活性,可以用电解法富集。而稳定态与电极无反应,不能被富集。这是用电化学法判别天然水中重金属的稳定态与不稳定态的重要依据。再辅以紫外光照射、强酸消解等方法,还可把稳定态进一步分为A、B两态。富集在工作电极上的铜膜,当由负电位等速向正电位扫描过程中电位达到铜的溶出电位时,铜即迅速氧化成铜离子,深入溶液中,同时形成一个溶出电流峰。在其它条件不变时,可以根据溶出电流峰高度来确定被测液中铜的含量。
本实验测定受铜轻度污染的湖水中铜的结合状态。湖水用0.45μm膜过滤,用XJP—821(B)型新极谱仪和ATA—1A型旋转园盘电极组成的极谱技术分别测定:(1)未加处理的滤液,(2)经光照处理后的滤液,(3)用硝酸和高氯酸消化后的滤液,(4)经硝酸和高氯酸消化后的悬浮物中的铜含量。显然,未加处理的滤液中被测出的只是不稳定态铜。而经紫外光照射后的是不稳定态加上稳定态A。经过硝酸和高氯酸消化后的则包括不稳定态、稳定态A和稳定态B。因此,经过计算后可以分别确定不稳定态、稳定态A、稳定态B和颗粒态的铜含量。
三、仪器与试剂
1、XJP—821(B)型新极谱仪
2、ATA—1A型旋转园盘电极
3、紫外灯照射器
4、电热板(800瓦)
5、微孔膜过滤器
6、真空泵系统
7、氮气钢瓶
8、移液管0.25mL、2mL、5mL、50mL、100mL
9、容量瓶100mL
10、浓HClO4(G.R.)
11、浓HNO3(G.R.)
12、30%H2O2(G.R.)
13、铜标准使用液:1.00mg/L
14、底液:3M NH4Cl—NH4Ac—NH3·H2O
四、实验步骤
1、水样采集和处理:用塑料桶取1升湖水,用玻璃纤维滤去大块颗粒物。再用100毫升移液管出200毫升水样放入微孔膜过滤器中抽滤。弃去前面10毫升滤液,余者存于冰箱中备用。小心以下微孔膜及悬浮物,放入150毫升烧杯内备用。
2、滤液光照处理:移取50毫升滤液到紫外灯照射器内,再加10滴30%H2O2,小心放入搅拌磁子。接通冷却水和电源,在搅拌中光照滤液2小时。照完后把滤液倒入100毫升烧杯中备用。
3、滤液消化处理:移取50毫升滤液到150毫升烧杯中,加2毫升浓HNO3,在电热板上煮沸。试液近干时加2毫升浓HClO4,继续加热到白烟将尽、内容物近干时为止。取下烧杯,冷却后加10毫升蒸馏水,电热板上煮沸1分钟。冷后移入100毫升容量瓶内,用蒸馏水定容备用。
4、滤膜处理:往盛有微孔膜和悬浮物的烧杯内加入10毫升蒸馏水和2毫升浓硝酸,然后继续按滤液消化处理过程操作。
5、测定:移取溶液50.0ml于电解池杯中,再加5.0mL 3M NH4Cl—NH4Ac—NH3·H2O
底液,将ATA—1A旋转园盘电极插入电解池内,调节电极转速,通高纯氮除氧5分钟。同时密封电解池系统,按下电极开关,触发富集键,2分钟后仪器自动静止30秒扫描,得到一个溶出峰,测量峰高h,重复前定3—4次(注意,每次测定前须进行电极电化学清洗)。然后,在电解池杯中加入0.25mL 1.00mg/L的铜标准液,在相同条件下重复测定3—4次,记录峰高H。
滤液光照试样、滤液消化试样、滤膜试样测定同上。
阳极溶出伏安法测定条件
上限电位(V) | -1.0 |
起始电位(V) | -0.9 |
下限电位(V) | 0 |
扫描速度(mv/s) | 100 |
富集时间(min) | 2 |
电极转速(转/分) | 1000 |
X轴量程(mv/cm) | 100 |
Y轴量程(mv/cm) | 50 |
五、数据处理:
1
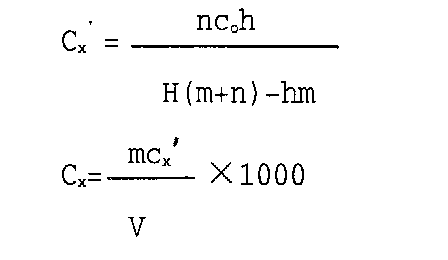
、根据下列公式计算不同方式处理试样的铜含量,结果填入下表:
式中:m:被测试液体积V+底液体积(mL)
n:加入铜标准液体积(ml)
Co:加入铜标准溶液浓度(mg/L)
Cx:被测试液含量(μg/L)
处理方式 | 直接处理 | 光照处理 | 消化处理 | 滤膜处理 |
被测液峰高h(mm) | ||||
加标后被测液峰高H(mm) | ||||
铜含量(μg/L) |
2、根据各种处理方式所得铜含量算出湖水中颗粒态、不稳定态、稳定态A、稳定态B的铜含量,把结果填入下表:
形 态 | 颗粒态 | 溶 解 态 | ||
不稳定态 | 稳定态A | 稳定态B | ||
铜含量 (μg/L) | ||||
六、讨论
1、由于湖水来源不同,铜含量不同,因而移取试样的体积和加入标准溶液的体积可视具体情况作适当调整。
2、在试液用HNO3和HClO4消化时,消化完全后应加热至白烟将尽,但勿蒸干。如溶液中剩有过多的酸,则试液酸度很高,影响测定;如蒸干,则局部温度过高,微量的铜可能挥发损失。
3、每经过一次溶出测定,需对电极进行电化学清洗,经扫描查验确无铜存在后再做下一次测定。
4、每个样品要取得重现性较好的溶出电流峰,必需注意使每次富集时间、静置时间、、电极清洗时间等保持严格一致。
七、思考题
1、为什么可用极谱技术来测定水中金属形态?
2、简述阳极溶出伏安法灵敏度高的原因?
3、为了保证测量准确,应注意哪些关键问题?
实验二 底泥中腐殖物质的提取和分离
一、目的要求:
1、加深对腐殖物质的感性认识;
2、提取和分离富里酸和腐殖酸,并测定某种特定的底泥中富有酸和腐殖酸的含量。
二、概述:
自然界中的腐殖物质是天然产物,主要存在于土壤、底泥、河流、湖泊及海洋中。它们是动物和植物躯体长期腐烂或者其他有机物分解和合成过程中形成的特殊物质。它们包括胡敏素、腐殖酸、富里酸等。富里酸的分子量较小,它溶于稀碱也溶于稀酸。腐殖酸只溶于稀碱不溶于稀酸。胡酸素不被碱提取。底泥中的腐殖物质常和不同的阳离子或不同形式的矿物质结合着。其中游离的腐殖物质可用稀碱提取,不溶于水的钙、铁、铝腐殖酸盐可用焦磷酸钠使之转化成溶于水的钠盐。
腐殖物质分子中各个结构单元上有一个或多个活性基团,如羧基、酚羟基、醌基等,它们可与金属离子进行离子交换、表面吸附、螯合作用等反应,因而使重金属污染物在环境中的迁移转化过程变得复杂,并产生重大影响。
本实验用稀碱和稀焦磷酸钠混合液提取底泥中的腐殖物质。提取物酸化后析出腐殖酸,而富里酸仍留在酸化液中,据此可将富里酸和腐殖酸分离开来,经过干燥之后测定其各自重量。
三、仪器与试剂:
1、水浴锅
2、台秤
3、分析天平
4、电动离心机
5、振荡器
6、离心管50毫升
7、碘量瓶250毫升
8、三角烧瓶250毫升
9、量筒100毫升
10、干燥器
11、称量瓶φ3—5cm
12、蒸发皿φ5—7cm
13、培养皿φ5—7cm
14、混和提取液:0.2M焦磷酸钠溶液和0.2M氢氧化钠溶液等体积混合均匀。
15、底泥:风干后磨碎过100目筛备用。
16、盐酸溶液1M
17、氢氧化钠溶液1M
四、实验步骤
1、称30克底泥,放入250毫升碘量瓶中,加入100毫升混合提取液,振荡器上振荡10分钟后,放置40到60小时。其间振荡二、三次。到时将混合物均匀倒入两个离心管中,尽量使两管重量相等。把两个离心管放在离心机的对称位置上离心10分钟。离心完将上层溶液倒250毫升三角瓶中,弃去管内泥渣。用1M盐酸溶液把瓶内溶液的pH值调到3左右,记下所用盐酸体积V毫升。调好pH值后,振荡1小时。到时离心10分钟。离心完,将上层溶液(主要是富里酸)倒入干净的250毫升锥形瓶内备用。离心管内残渣主要含腐殖酸,也保留备用。
取一个已烘至恒重的玻璃蒸发皿,称得重量G(标准)到0.002克,下同。
再移入20毫升富里酸溶液,用1M氢氧化钠溶液将其pH调到7,然后放在沸水浴上蒸干。在105℃烘箱内烘至恒得后称出重量W(克)。再取一个蒸发皿作空白实验,吸取------毫升提取液,扣除提取液中所引入的盐类质量Q(克)。
3、取一张定量滤纸,放至称量瓶中,开盖放在105℃烘箱内烘至恒重。盖好瓶盖在分析天平上称出重量A(克)。取出滤纸,放在玻璃漏斗内。用pH为3的蒸馏水把腐殖酸渣转移入漏斗内过滤。滤干后取出滤纸,放回原称量瓶中,在105℃烘箱内烘至恒重后再称出重量B(克)。
五、数据处理
按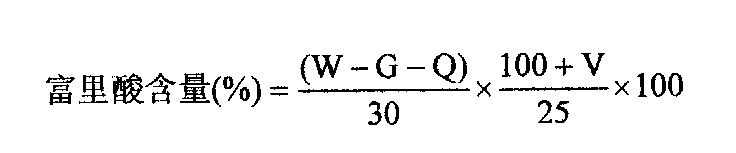 下式计算底泥中富里酸含量:
下式计算底泥中富里酸含量:
按下式计算底泥中腐殖酸含量:
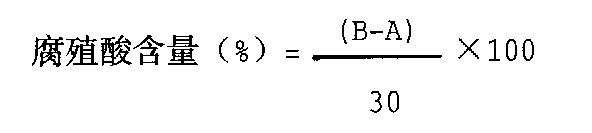
腐殖物质含量数据表
W | G | Q | B | A |
六、思考题:
1、环境中的腐殖物质对重金属污染物的迁移转化起什么作用?
2、称量烘干后的滤纸时,为何要盖上称量瓶的盖子?
3、富里酸和腐殖酸在外观上有何区别?
实验三 土壤的阳离子交换量的测定
一、目的要求
1、掌握土壤中阳离子交换量的测定;
2、根据土壤阳离子交换量学会评价土壤的肥力和土壤的解毒作用。
二、概述
土壤是植物生长的依据,微生物活动的场所,也是环境污染物迁移转化的重要场所,重金属等污染物通过土壤的吸附和交换达到净化。土壤的吸附及交换和土壤的组成,结构等有密切关系,因此,测定土壤的性质有助于了解土壤对污染物的净化能力和土壤污染负荷。
按照土壤的化学组成主要含有:无机矿物质、有机物和各种微生物。
土壤中的无机矿物质主要成分为粘土矿物,它本身为细小的硅酸盐颗粒,能电离释放出可移动的金属离子成为带负电荷的硅酸离子,而且矿物晶格中的层状硅铝酸盐系由硅氧四面体和铝氧八面体结构所组成,土壤中四面体硅氧层中的Si4+常被Al3+部分置换,八面体铝氧层中的Al3+部分被Fe2+,Mg2+等置换,结果都能使土壤胶体产生负电荷。土壤表面的负电荷从静电力吸附土壤溶液中正电荷的阳离子,保持电中性土壤表面存在阳离子主要为Ca2+,Mg2+,Na+,K+,H+等,它们的含量决定粘土矿物的阳离子交换能力。
土壤有机质主要是腐殖质,腐殖质不是一种纯的固定化学组成的物质它们按其溶解性分为:一是不能被碱萃取的胡敏素,二是虽可被碱萃取,但把萃取液酸化沉淀析出的酸不溶性的腐殖酸,三是酸化时不沉淀的富里酸。腐殖质成分复杂,分子量不固定,结构上含多种活性基团,其中酚羟基,羧基都具有很大的阳离子交换能力对重金属等污染物在土壤中的吸附,络合起重要作用。
土壤表面的可移动阳离子可用中性盐中的离子交换,它们的反应是等量的可逆反应,例如,
土壤
土壤
Ca2+ Ca2+
Mg2+ Ba2+ Mg2+


K+ +3Ba2+ Ba2+ + K+
Na+ Ba2+ Na+
上述交换反应不能进行完全。增大交换液浓度,增加更新交换液次数可使交换反应近于完全。除外,交换能力大上取决于土壤的组成和性质和交换离子的性质。
在上述反应中,当使用过量的强电解质BaCl2处理土壤,被交换的Ba2+用一定浓度H2SO4处理,被H+置换下来Ba2+和SO42-生成BaSO4沉淀而有利于反应进行完全。通过测定交换反应前后H2SO4含量的变化计算阳离子交换量(总量)。土壤阳离子交换量常用每100克干土中的毫克当量数表示。
三、仪器与试剂
1、电动离心机
2、离心管50毫升(每组两只)
3、锥形瓶100毫升(每组两只或六只) 250毫升(2只)
4、量筒25毫升(2只)
5、移液管10毫升(1只) 25毫升(11只)
6、碱式滴定管25毫升(或50毫升)1只
7、试管20毫升(2只)及玻棒(若干)
8、0.1000M NaOH标准溶液:称2克分析纯NaOH溶于500毫升新煮沸后冷却的蒸馏水(去离子水)中。称取0.500克分析纯的邻苯二甲酸氢钾(预先在105℃烘干)2份于250毫升锥形瓶中,加100毫升经煮沸后冷却的蒸馏水溶解,加1%酚酞酒精溶液4滴,用NaOH标准溶液滴定到淡红色。用煮沸后冷却的蒸馏水同上述步骤测定空白值,计算时扣除空白值按下式计算:
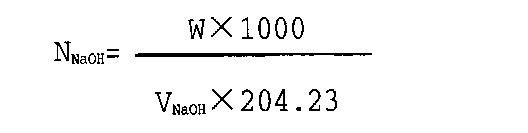
式中W—苯二甲酸氢钾重量(克),VNaOH—扣除空白值的耗用的NaOH溶液的体积(毫升)。
9、BaCl2(0.5M):称60克BaCl2·2H2O溶于500毫升蒸馏水。
10、酚酞酒精溶液(1% W/V):称取1克酚酞溶于100毫升乙醇中。
11、H2SO4(0.1M)
12、土壤样品;土样经风干、磨碎、过筛(200目)
四、实验步骤:
1、取两只洗净烘干,重量相近的50毫升离心管在天平上准确称得重量(W克,到小数三位)往离心管中分别加入1.000克,经预先风干,磨碎,过筛的不同的土壤样品(做好记号)。
2、用量筒向各管中加入20毫升0.5M BaCl2溶液,搅拌5分钟,把离心管放在离心机内,以每分钟3000转的转速离心,直到管内上层溶液澄清,下层土壤紧密结实(约5分钟)。离心毕,倾去上层清液,再加20毫升0.5M BaCl2溶液重量上述操作,弃清液,保留管内土样。
3、每只离心管加20毫升蒸馏水,用玻棒充分搅拌离心管内容物,在离心机上离心(操作同上)。离心毕,弃上层清液,将离心管(含土样)在天平上称重[G=(土样+离心管+残存水)重量]。
4、准确移25毫升0.1M H2SO4,搅拌10分钟,放置20分钟,离心沉降。离心清液分别倒入洗净、烘干的试管内。各移出10毫升离心清液2份到100毫升锥形瓶内。另外移取2份10毫升0.1M H2SO4到另两个100毫升锥形瓶内。往每一锥形瓶各加入10毫升蒸馏水和1滴酚酞指示剂,用0.1000M NaOH标准溶液滴定到微红色(红色一分钟不褪)。记下各测定耗用的NaOH溶液的体积(A和B)和浓度(NNaOH)。
土 样 | 土样Ⅰ | 土样Ⅱ | 硫 酸 滴 定 值 (A) | 1 | |||
1 | 2 | 1 | 2 | 2 | |||
干土重(克) | 平 均 (mL) | ||||||
W(克) | |||||||
G(克) | |||||||
M(克) | |||||||
B(毫升) | NNaOH | ||||||
交换量 | |||||||
平均交换量 | |||||||
W=离心管重(克) G=(土样+离心管+残存水)重(克)
m=(G-W-土样)重 B=处理土样后0.1M硫酸所耗用NaOH体积
A=0.1M H2SO4耗用NaOH体积
NNaOH=NaOH标准液浓度
五、结果处理
实验结果计算阳离子交换量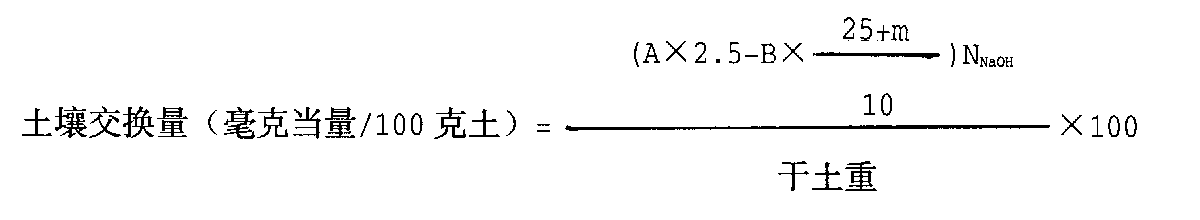
六、思考题:
1、土壤阳离子交换能力是由土壤中那些物质所提供?
2、既然交换剂阳离子态能影响交换能力,能否用Fe3+,Al3+高价阳离子进行土壤交换量的测定,说明原因。
3、试设计土壤阳离子交换量测定的方法(除本法外)
4、试就实验结果说明不同层次土壤的阳离子交换量差别的原因。
5、试说明土壤的离子交换,吸附对污染物的迁移,转化的影响。